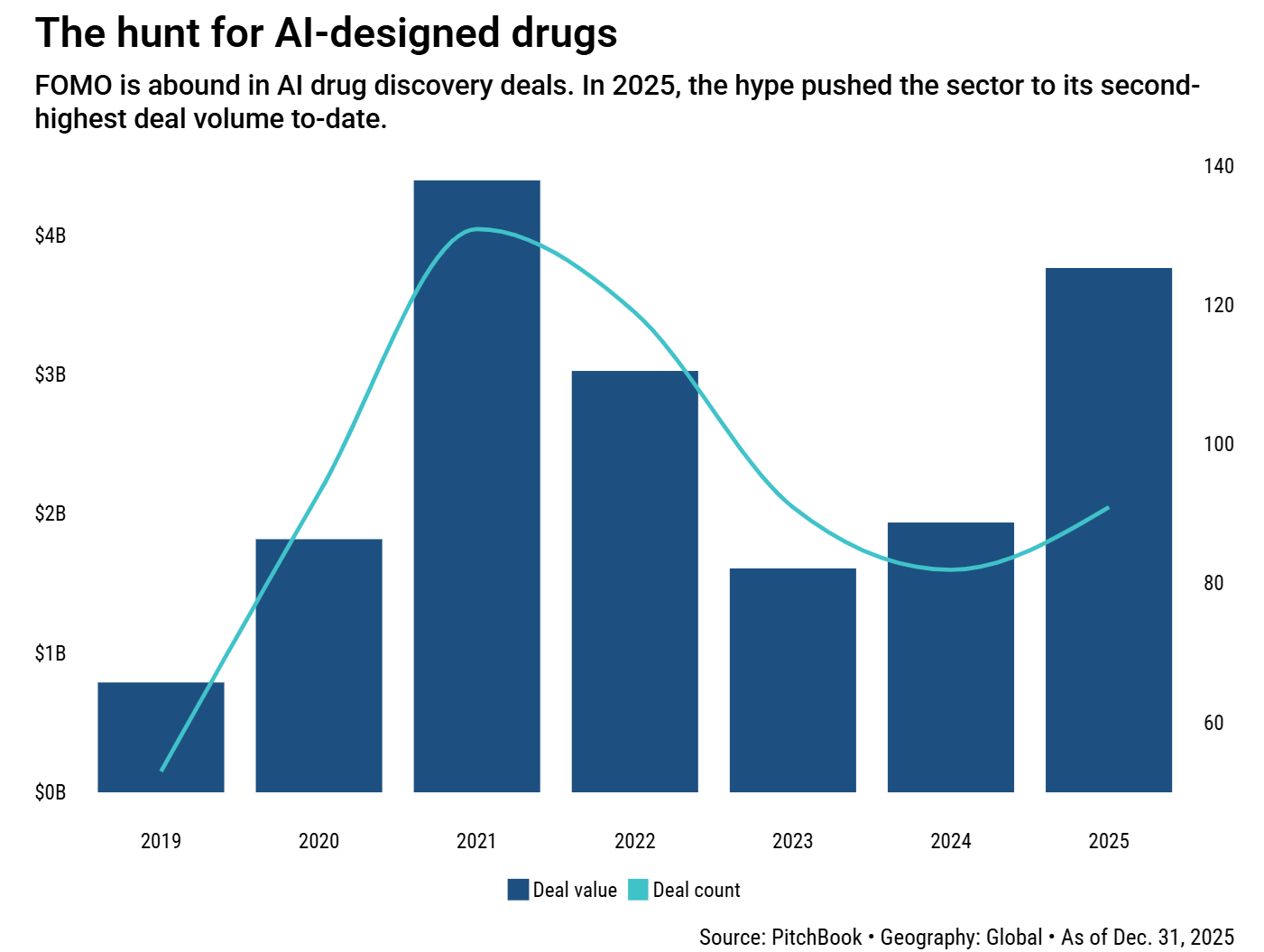
17,3 milliárd dollár – 2019 óta eddig összesen ekkora összeget fektetett be a globális kockázati tőke abba, hogy AI segítségével fejlesszen gyógyszereket.
Ha az egyes éveket nézzük, a pandémia tőkebummjának lecsengesését követő legerősebb év pont a tavalyi volt, 91 darab deallel, összesen 3,8 milliárd dollár értékben a PitchBook elemzése szerint.
Ahogyan arról korábban írtunk: ezt a VC-piaci konszolidáció mellett a biotechnológiát is átható AI-bumm okozza. Az AI gyors fejlődése egyre több kockázati tőkebefektetőt ösztönöz arra, hogy megvizsgálja a biotechnológiában rejlő lehetőségeket.
Az olyan területek, mint a gyógyszerkutatás, különösen vonzóak, mert az AI felgyorsíthatja az évekig tartó folyamatokat, csökkentheti a költségeket és lerövidítheti a termékek piacra kerülésének időtartamát.
Nem véletlen, hogy 2025-ben a legnagyobb európai biotech deal is egy gyógyszerkutatást AI-jal újragondoló, londoni céghez, az Isomorphic Labs nevéhez kötődik, amely március végén jelentette be 600 millió dollár (közel 523 millió euró) értékben megkötött Series A körét a Thrive Capital vezetésével.
A beáramló tőke ellenére azonban sem az Isomorphic Labs, sem más versenytársa nem jutott el mindezidáig a nagyszabású klinikai kísérletekig, ami felveti a kérdést:
hiba volt a FOMO (a kimaradástól való félelem) által gerjesztett hypevonatra felülnie a globális kockázati tőkének az AI gyógyszerfejlesztés kapcsán?
Sem a biológiai ismereteink, sem az AI-modellünk nincs meg
Ezt így kategorikusan nem jelenthetjük ki, az azonban biztos, hogy a befektetőknek lassabb ritmusra kell berendezkedniük.
Egyrészt – mint azt a PitchBook elemzése kifejti – az AI jelenléte nem változtatja meg a gyógyszeripari szabályozást, ami igencsak hosszadalmassá teszi az új gyógyszerek fejlesztését és forgalomba hozatalát.
Egy-egy lehetséges gyógyszer azonosítását a sok időt és pénzt felemésztő klinikai tesztelési folyamat követi, ami önmagában több kihívást foglal magába: a gyógyszernek először egy sor biztonsági vizsgálaton kell átesnie, majd egészséges önkénteseken, azt követően pedig százas nagyságrendben betegeken kell azt tesztelni. És csak ezután jöhet a hosszú távú mellékhatások vizsgálata, ami önmagában akár éveket is felölelhet.
Nem véletlen, hogy a klinikai vizsgálati szakaszban bukik el a gyógyszerjelöltek 85 százaléka, és összességében akár 10-15 évbe is telhet, mire egy gyógyszer eljut a szabályozói jóváhagyásáig.
Ezen némileg javíthat az Európai Unióban az előreláthatólag már idén debütáló Biotech Act, ami megkönnyítené a biológiai termékek – például gyógyszerek és élelmiszerek – fejlesztését és piacra dobását, miközben fenntartaná a magas biztonsági színvonalat, és növelné az EU versenyképességét.
Az ördög azonban a részletekben rejlik: mint arra Pat Walters, az OpenADMET AI gyógyszerkutatási projekt vezető tudósa rávilágított,
a klinikai vizsgálatokon való elhasalások legfőbb oka az, hogy egyszerűen nem értjük eléggé a biológiát.
Ezt támasztotta alá az úgyszint gyógyszerkutatásban dolgozó Derek Lowe, aki szerint sokkal több ismeretre lenne szükség „az emberi biológiáról, az egészségről és a betegségekről”, mint ami jelenleg a rendelkezésünkre áll: az adatkészletek ugyan hatalmasak, de rendezetlenek és hiányosak. Például az antitestterápiák esetében – amelyek különösen ígéretes területet jelentenek az AI-alapú gyógyszerkutatásban – a lehetséges fehérjeszerkezetek száma még mindig „meghaladja az emberi felfogóképességet”.
És ha egy ilyen adatkészletre alapozzuk az AI-t, az szükségszerűen töredékes hasznosulást képes csak hozni. Mint azt Duxin Sun, a Michigan Egyetem gyógyszerészeti tanszékének dékánhelyettese és professzora megfogalmazta:
„a gyógyszerkutatásban még nincs meg a modell algoritmus”, és a jelenlegi biokémiai algoritmusoknak még hosszú utat kell megtenniük, mielőtt valóban generatívakká válhatnak.
Így azonban jelenleg nincsen olyan AI-modell, amely előre tudná jelezni, hogy egy gyógyszerjelölt nagyobb valószínűséggel fog-e megfelelni a klinikai tesztelés három nagy kritériumának: a hatékonyságnak, a biztonságosságnak és a megfelelő adagolásnak.
Van értelme AI-gyógyszerfejlesztésbe fektetni, csak nagyon türelmesnek kell lenni
Ez azonban nem jelenti azt, hogy az AI-alapú gyógyszerfejlesztés egy helyben toporogna: elég csak David Baker, Demis Hassabis és John Jumper közös megoldására gondolni, ami a földi élethez nélkülözhetetlen fehérjék térbeli szerkezetének feltárását lehetővé téve egy 50 éves problémát oldott meg, és ami 2024-ben kémiai Nobel-díjat érdemelt.
Az AlphaFold 2 néven futtatott modell egy jó példa arra, hogy az AI-gyógyszerkutatás fejlődik, de azt nem várhatjuk, hogy az AI megjelenése a területen olyan hirtelen felívelést hozzon, mint mondjuk a védelmi technológiákban.
Azonban annak a költségcsökkentő hatását sem szabad lebecsülni – hívta fel rá a figyelmet Duxin Sun –, ha az AI-jel tervezett gyógyszerek gyorsabban jutnak el a klinikai kísérleti szakaszig, és ott gyorsabban buknak el, mint a hagyományos emberi fejlesztések.
Pat Walters szerint nem a mesterséges intelligencia lesz az a csodaszer, aminek hála a biológiai ismereteink hirtelen kitágulnak, de mindenesetre segíthet a problémák megoldásában. Mint azt Lowe hozzátette: az AI-alapú gyógyszerfejlesztésben nagyon-nagyon nehéz problémákkal kell szembesülni, de nincsen okunk azt feltételezni, hogy azok megoldhatatlanok.
Addig is azonban a kockázati tőkéseknek arra kell berendezkedniük, hogy a pénzük valószínűleg nem olyan gyors ütemben fog megtérülni, mint ahogyan azt más területeken megszokhatták, és ha nagyot akarnak nyerni, türelmesnek kell lenniük.
NYITÓKÉP: Az Isomorphic Labs kreatívja a cég honlapján